香港大学(港大)科研团队在细胞微管研究取得重大突破,首次揭示微管蛋白如何透过机械力学感应控制细胞活动。这项由港大工程学院机械工程系林原教授与港大李嘉诚医学院生物医学学院狄士杰教授共同领导的研究,为理解细胞“骨架”运作机制带来新见解。

微管作为细胞骨架核心组件,是由微管蛋白异二聚体组成的中空管状结构,不仅维持细胞形态,更参与物质运输等关键生理过程。微管需要与多种蛋白质相互作用——部分作用于微管外表面,另一些则作用于其管腔。尽管微管外表面易于接近,但管腔结合蛋白如何进入受限的微管内腔仍是未解之谜。研究团队运用跨学科研究方法,结合生物、物理学、机械工程等技术,成功破解微管“门控”之谜。
狄士杰教授团队透过“单分子萤光生物检测”配合机械仪器操作(图1),发现微管蛋白亚型(即微管蛋白的不同变体)作为力感应元件能够调控微管管腔可及性,从而使得酶与微管内腔表面发生相互作用。
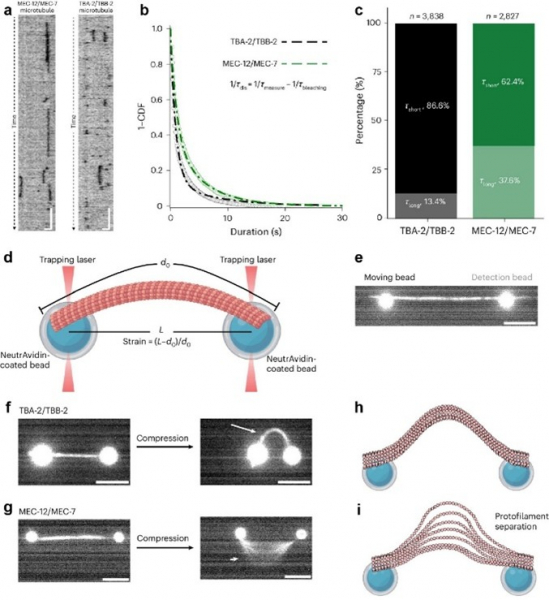
研究团队利用三维电脑模拟技术构建微管精细模型,发现特定微管蛋白亚型因横向相互作用较弱,在机械外力作用下可产生纳米级缝隙(图2)。
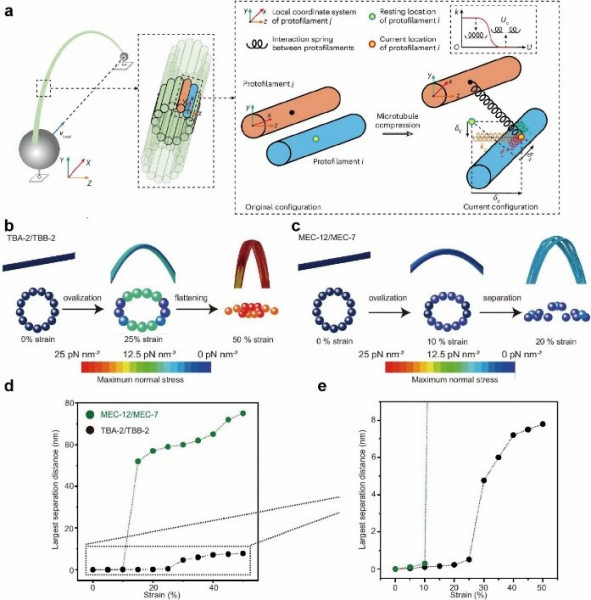
林教授指出:“实验证实,这些缝隙的大小恰到好处,足以让管腔结合蛋白等关键物质进出,犹如细胞内的智能开关。”研究分析显示,不同微管蛋白亚型的组合能精确调控微管的机械特性,使其能够差异化响应热力波动或外界机械刺激。这种动态调节机制解释了细胞如何灵活适应环境变化,突破物理限制并维持内部物质运输的稳定性。
林原教授与狄士杰教授表示:“此项研究不仅加强我们对细胞机械转导现象的理解,未来还有望为先进活性生物材料的研发提供关键线索。”
研究成果已发表于《自然-物理》(Nature Physics),文章标题为“Tubulin isotypes of C. elegans harness the mechanosensitivity of the lattice for microtubule luminal accessibility”。







 今日热搜
今日热搜









 查看更多
查看更多















