编者按:GLP-1受体激动剂(GLP-1RA)已经彻底改变了肥胖的治疗方式,但是在享受轻松减掉脂肪的同时,可能减少以肌肉为主的去脂体重。在第二十届湘雅国际糖尿病免疫学论坛上,美国弗吉尼亚大学内分泌及代谢病科刘振启教授就糖尿病和肥胖精准干预这一话题,从肌肉流失、ADA指南推荐、运动干预、营养调节到肌肉保护策略进行了全面梳理,旨在为GLP-1RA治疗期间保持肌肉质量和优化身体成分结构提供新的思考!
一、提示:GLP-1受体激动剂减脂亦减肌?
近些年,GLP-1或GLP-1/GIP受体激动剂药物已被有效开发、获批减重适应证并被广泛应用于临床,如Liraglutide(利拉鲁肽)、Semaglutide(司美格鲁肽)和Tirzepatide(替尔泊肽)。然而,2025美国糖尿病协会(ADA)指南提示,新型减重药物以及用于减重的代谢手术可能增加营养不良和肌肉减少症的风险,特别是在患有心脏、肾脏或肝脏疾病以及肥胖症的人群中。
减重药物在减重过程中会同时减少脂肪和去脂体重(包括肌肉等)。如利拉鲁肽治疗引起的总减重中,LBM(瘦体重)/FFM(去脂体重)对总减重的相对贡献范围为30%至47%;艾塞那肽也报告了相似的结论,LBM贡献可能高达40%至50%。
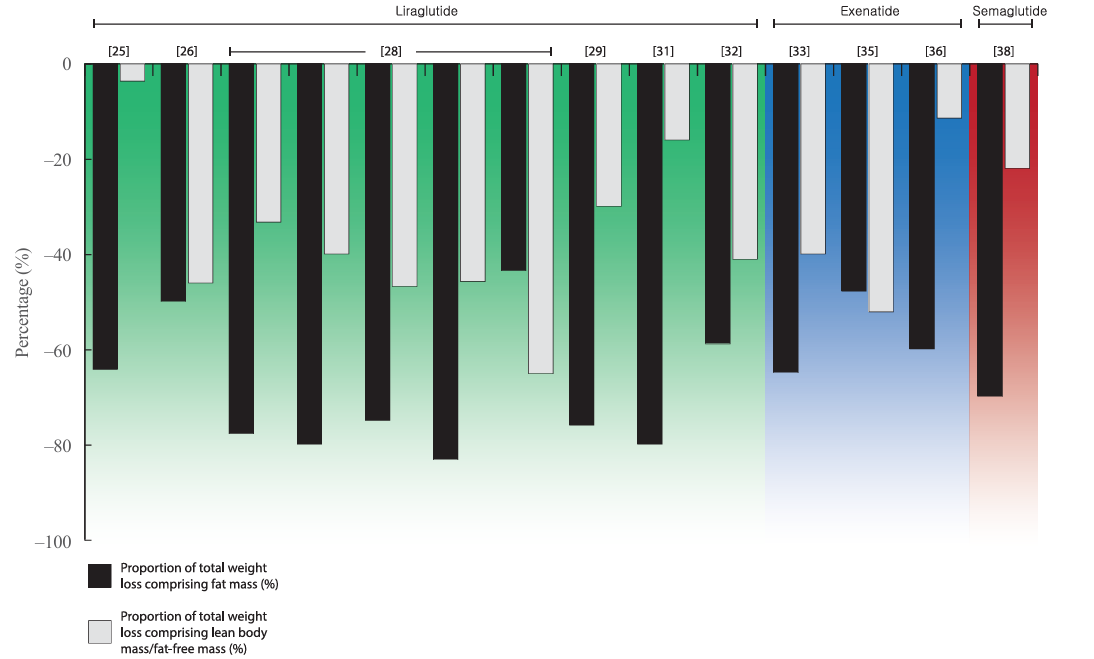
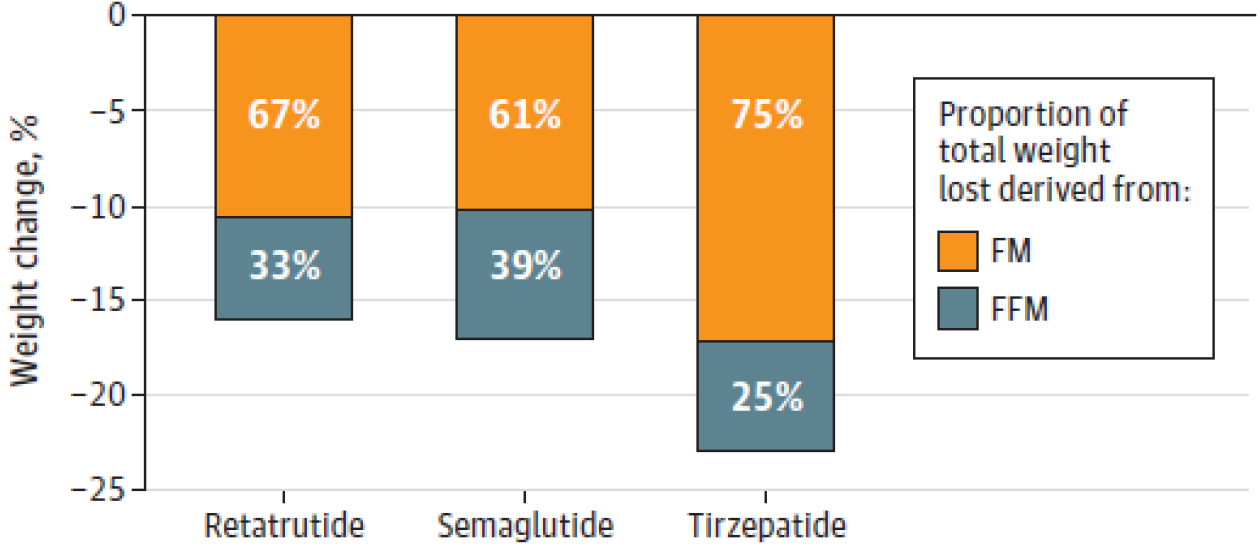
2024年发表在JAMA的一篇文献也报道了类似结论,在GLP-1RA引起的体重减轻中,Retatrutide(瑞他鲁肽)、司美格鲁肽和替尔泊肽的FFM贡献范围分别为33%、39%和25%(图2)。这些研究提示,患者在接受体重管理的药物治疗时,瘦体重的变化尤为值得临床上多学科的关注。
二、为什么关注肌肉流失?
只减脂肪不护肌肉,可能让身体“瘦而不健”,反而陷入代谢更差、体能更弱的恶性循环。一项荷兰Lifelines队列研究纳入了119 494名18~90岁的参与者,在普通人群中评估了肌肉减少性肥胖(Sarcopenic Obesity,SO)和肌肉减少性超重(Sarcopenia with Overweight,SOW)的患病率及相关因素。研究发现年龄是SO和SOW的重要决定因素,50岁时患病率上升。在所有SO和SOW参与者中,分别有82.5%和80.4%低于70岁(图3)。提示肌肉流失防控需超越老年医学范畴,生活方式干预(如运动与营养)是潜在预防手段。
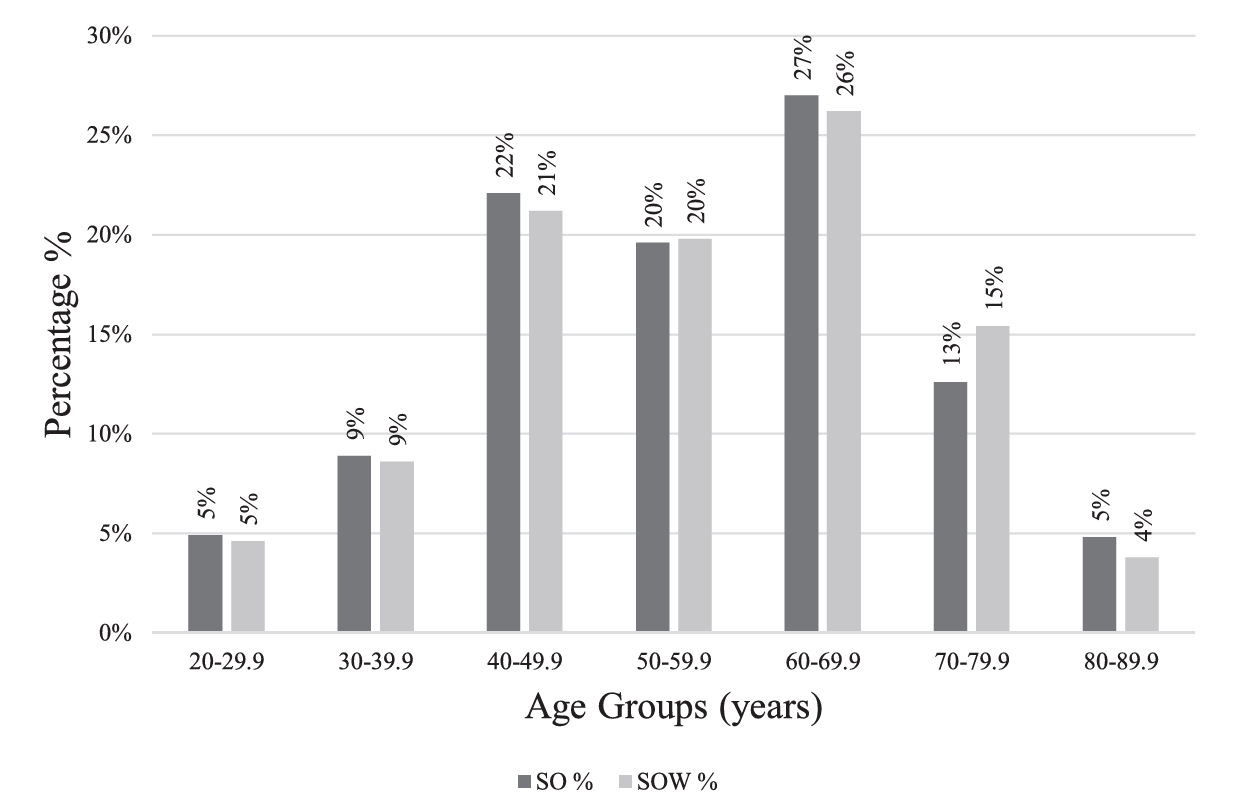
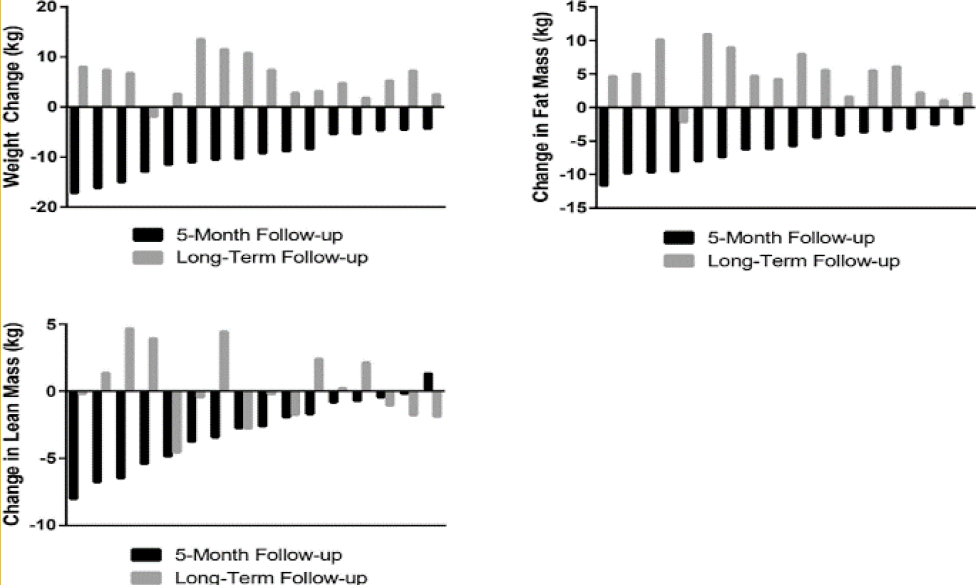
另一项在肥胖和伴随保留射血分数的心力衰竭老年患者中进行的热量限制和运动训练(SECRET)研究发现,5个月干预后在28个月长期随访时,平均体重上升主要是由于FM的增加,而LBM未发生显著变化,导致瘦体重-脂肪比下降(图4)。另外,从5个月干预结束到长期随访结束,峰值摄氧量(VO2peak)和运动时间均显著减少,且脂肪体重增加与VO2peak下降呈负相关,需要制定长期坚持策略,以防止体重反弹,改善运动能力。
三、运动和营养干预:肌肉保护策略
2025美国ADA指南[4]建议:鼓励进行抗阻训练、足够的蛋白质摄入,并筛查肌肉减少症和营养不良;还建议采用健康的全食物饮食模式,并结合定期的力量训练,以维持瘦体重。具体推荐为以下两个方面:
医学营养治疗-保证蛋白质摄入
- 推荐每日蛋白质摄入0.8~1.5 g/kg或总热量的15%~20%
- 蛋白质摄入目标应根据当前饮食模式个体化
- 稍微高一些的蛋白质水平(20%~30%)可能有助于增加饱腹
- CKD患者不需将蛋白质摄入限制在低于一般推荐量
体育活动
- 每周进行至少150分钟的中等至高强度有氧运动,分布在至少3天内,且连续两天不得无活动
- 每周进行2~3次非连续日的抗阻力锻炼
- 接受减重药物治疗或代谢手术的成年人和青少年,进行增强肌肉的锻炼,可能对维持瘦体重有益
四、结语
肥胖会降低肌肉质量且增加低肌肉量的风险。GLP-1RA可能会在减脂同时损失去脂体重。推荐在开始GLP-1RA治疗之前,积极筛查肌肉减少症和营养不良的合并情况。在GLP-1RA治疗期间,鼓励进行抗阻训练,并确保摄入足够的蛋白质。最后,我们期待更多研究的积极开展,并在内分泌科、营养科、康复科等多学科的通力合作和指导下,更安全有效的使用减重药物,再配合患者个体方面的营养和运动坚持,最终优化身体成分,促进肌肉健康!















 查看更多
查看更多










